
2017年9月4日,国家食品药品监督管理总局(以下简称“国家总局”)举行新闻发布会,正式发布新修订的《医疗器械分类目录》(以下简称新《分类目录》)。自2018年8月1日起实施。
目前, 我国约有7.7万余个医疗器械注册证和3.7万余个医疗器械备案凭证。随着医疗器械产业的快速发展,新技术、新产品的不断涌现,医疗器械分类体系已难以适应产业发展和监管工作的需要,2002年版《医疗器械分类目录》(以下简称原《分类目录》)的不足日益凸显:一是原《分类目录》不够细化,整体框架和层级设置不能满足产业现状及监管要求。二是原《分类目录》缺乏产品描述和预期用途等关键信息,影响注册审批的统一性和规范性。三是原《分类目录》难以覆盖新产品、新类别,由于缺少动态调整机制,使得目录内容不能及时更新,产品类别划分不够合理。
其中2002年版《医疗器械分类目录》中,在6841医用化验和基础设备器具中,出现品名为“采血针”(末梢采血针),容易与6815注射穿刺器械中品名为“穿刺针”(动静脉采血针)混淆,容易引起歧义导致市面上存在不同厂家的一次性使用静脉采血针出现不同管理类别的注册证,例如有些厂家静脉采血针是III类注册证,有些厂家静脉采血针是II类注册证。


本次新《分类目录》明确指出,动脉血气针、一次性使用动静脉采集针、一次性使用真空动静脉采血针,均归属三类医疗器械管理类别,剔除了品名“采血针”的二类医疗器械管理类别。
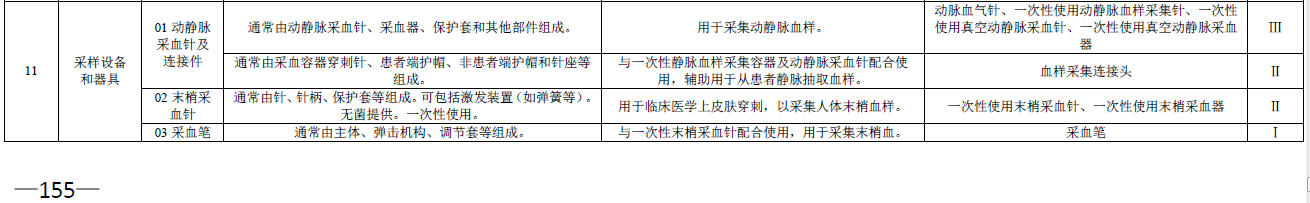
本次新《分类目录》同时也指出一次性使用真空采血管、一次性使用真空静脉采血管、一次性使用真空静脉血样采集容器、一次性使用静脉血样采集容器、一次性使用非真空采血管,均归属二类医疗器械管理类别,相比2002年版中品名“真空采血管”做了进一步细致的划分,便于产品的管理。

游离DNA保存管作为一种真空采血管,也属于二类医疗器械,根据卫计委《孕妇外周血胎儿游离DNA产前筛查与诊断技术规范》要求:设备、试剂和数据分析软件应当符合《医疗器械监督管理条例》和《医疗器械注册管理办法》等相关规定,经过食品药品监督管理部门批准注册。因此,游离DNA保存管必须取得二类注册证。
总局关于发布医疗器械分类目录的公告(2017年第104号)官网链接:http://www.sda.gov.cn/WS01/CL0087/177089.html

